里程碑|宇耀生物首个创新药临床(IND)获批
2022年3月3日,宇耀生物自主研发的新一代EP4受体小分子拮抗剂YY001临床试验申请正式获得国家药品监督管理局(NMPA)批准,同意针对晚期实体肿瘤开展1期临床试验。这是宇耀生物获得的中国首个IND批件,该靶点全球尚无同类药物上市,其1期临床即将在上海市东方医院开展。
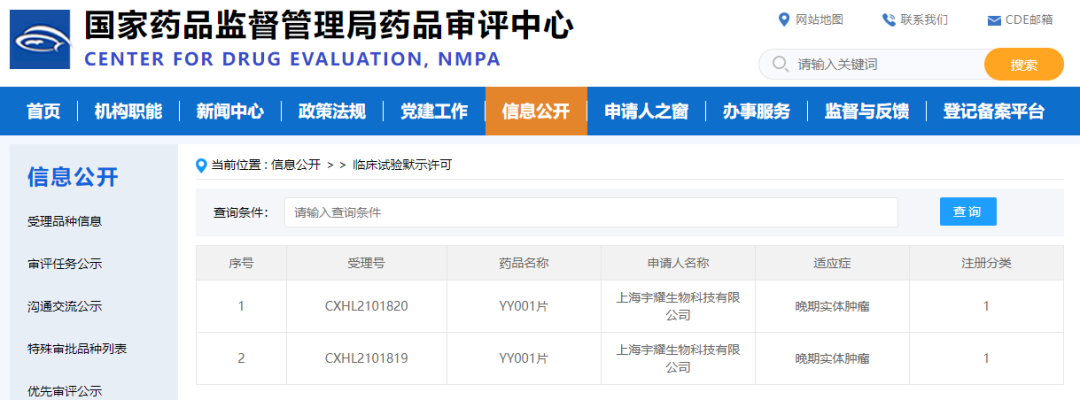

YY001是宇耀生物自主研发的新一代EP4受体小分子拮抗剂,也是国内首个自主原研高选择性EP4受体拮抗剂。相较处于临床试验各阶段的竞品,其临床前研究数据显示,靶点活性提高了5-10倍, 口服生物利用度提高2倍,体内血药浓度提高了4倍,是一个全方位的全球同类最佳(Best-in-class)产品。
宇耀生物YY001的临床前药效研究显示其在结直肠癌、胃癌和前列腺癌等晚期实体肿瘤中表现出显著的抗肿瘤作用,并且在和PD-1抗体联用时显著增强治疗效果,有望将PD-1抗体治疗不敏感的冷肿瘤转变为热肿瘤,为晚期实体瘤的治疗提供新的策略,造福更多的中国乃至全球晚期癌症患者[1,2]。
宇耀生物CEO周文波博士表示:
“YY001的提前获批是公司与CDE监管部门充分沟通、协力合作的结果,也充分表明了CDE对公司临床前数据的高度认可。YY001是国内原研首个靶向EP4的新药临床批件,目前该靶点尚无同类药物上市。宇耀生物作为国内首家获批的具有全球知识产权的临床批件,填补了该领域国内的空白。YY001的获批是宇耀生物全球顶尖科学家与资深工业化团队科研成果转化的典范,今年我们还将有多个中美临床批件的获批。”
宇耀生物董事长刘明耀博士表示:

关于宇耀
上海宇耀生物科技有限公司由中美顶尖科学家创建成立,目前已有博士和硕士员工30余名,在闵行区温度科技园拥有5000余平的办公和研发实验室。
公司有3大药物发现平台和8个在研产品管线针对发生率和死亡率前十的肺癌、前列腺癌、胰腺癌和胃肠道肿瘤等进行了全方位布局。产品YY001是通过肿瘤免疫治疗PD-1不敏感的晚期实体瘤,即将开展临床1期实验,是一个全球最优(Best-in-class)的免疫检查点拮抗剂。产品YY002是全球首创(First-in-class)的转录因子抑制剂,已经在中国和美国进行IND申报准备中,未来其他产品管线也即将陆续进入临床。公司目前已申请发明专利13余项和PCT专利4项并成功进入欧美、日本等国家与地区。
公司先后斩获第七届“创青春”中国青年创新创业大赛金奖(上海市唯一)、第六届“互联网+”大学生创新创业大赛金奖以及全国第一届博士后创新创业大赛金奖等荣誉。公司团队和产品也受到众多专业投资机构认可,目前已经获得5家机构数千万元天使投资。丰富的产品管线和全球顶尖的新药研发团队有望使公司在未来3-5年登陆资本市场,成为一家具有全球竞争力的创新药企业。
文章来源:宇耀生物


